Kürzlich veröffentlichte JAMA Oncology (IF 33.012) ein wichtiges Forschungsergebnis [1] des Teams von Prof. Cai Guo-ring vom Krebskrankenhaus der Universität Fudan und Prof. Wang Jing vom Renji-Krankenhaus der Medizinischen Fakultät der Shanghai Jiao Tong University in Zusammenarbeit mit KUNYUAN BIOLOGY: „Früherkennung molekularer Resterkrankungen und Risikostratifizierung für Dickdarmkrebs im Stadium I bis III durch Methylierung zirkulierender Tumor-DNA und Risikostratifizierung)“. Diese Studie ist die erste multizentrische Studie weltweit, bei der eine PCR-basierte Blut-ctDNA-Multigen-Methylierungstechnologie zur Vorhersage und Überwachung des Wiederauftretens von Dickdarmkrebs eingesetzt wird. Sie bietet einen kostengünstigeren technischen Weg und eine kostengünstigere Lösung im Vergleich zu bestehenden MRD-Erkennungstechnologien, wodurch der klinische Einsatz der Vorhersage und Überwachung des Wiederauftretens von Dickdarmkrebs erheblich verbessert und das Überleben und die Lebensqualität der Patienten deutlich verbessert werden dürften. Die Studie wurde von der Zeitschrift und ihren Herausgebern hoch bewertet und in dieser Ausgabe als wichtige Empfehlung aufgeführt. Professor Juan Ruiz-Bañobre aus Spanien und Professor Ajay Goel aus den USA wurden zur Begutachtung eingeladen. GenomeWeb, ein führendes biomedizinisches Medium in den USA, berichtete ebenfalls über die Studie.

Kolorektaler Krebs (CRC) ist ein in China häufiger bösartiger Tumor des Magen-Darm-Trakts. Daten der Internationalen Agentur für Krebsforschung (IARC) aus dem Jahr 2020 zeigen, dass 555.000 Neuerkrankungen in China etwa einem Drittel der weltweiten Fälle entsprechen und die Inzidenzrate damit auf den zweiten Platz der häufigsten Krebserkrankungen in China gestiegen ist. 286.000 Todesfälle entsprechen etwa einem Drittel der weltweiten Fälle und sind damit die fünfthäufigste krebsbedingte Todesursache in China. Es ist die fünfthäufigste Todesursache in China. Es ist bemerkenswert, dass unter den diagnostizierten Patienten 18,6 %, 42,5 %, 30,7 % und 8,2 % die TNM-Stadien I, II, III und IV aufweisen. Über 80 % der Patienten befinden sich im mittleren oder späten Stadium und 44 % von ihnen haben gleichzeitige oder heterochrone Fernmetastasen in Leber und Lunge, die die Überlebenszeit ernsthaft beeinträchtigen, die Gesundheit unserer Bürger gefährden und eine schwere soziale und wirtschaftliche Belastung darstellen. Laut Statistiken des Nationalen Krebszentrums steigen die Behandlungskosten für Dickdarmkrebs in China jährlich um durchschnittlich 6,9 bis 9,2 Prozent. Die persönlichen Gesundheitsausgaben der Patienten können innerhalb eines Jahres nach der Diagnose 60 Prozent des Familieneinkommens ausmachen. Krebspatienten leiden unter der Krankheit und stehen zudem unter großem wirtschaftlichen Druck [2].
90 % der Darmkrebsläsionen können operativ entfernt werden. Je früher der Tumor erkannt wird, desto höher ist die 5-Jahres-Überlebensrate nach radikaler chirurgischer Resektion. Die allgemeine Rezidivrate nach radikaler Resektion liegt jedoch immer noch bei etwa 30 %. Die 5-Jahres-Überlebensraten bei Darmkrebs in der chinesischen Bevölkerung betragen 90,1 %, 72,6 %, 53,8 % und 10,4 % für die Stadien I, II, III und IV.
Minimale Resterkrankung (MRD) ist eine Hauptursache für Tumorrezidive nach radikaler Behandlung. In den letzten Jahren hat sich die MRD-Erkennungstechnologie für solide Tumoren rasant weiterentwickelt, und mehrere umfangreiche Beobachtungs- und Interventionsstudien haben bestätigt, dass der postoperative MRD-Status das Risiko eines postoperativen Rezidivs von Darmkrebs anzeigen kann. ctDNA-Tests bieten die Vorteile, nichtinvasiv, einfach und schnell zu sein, eine hohe Probenzugänglichkeit zu bieten und die Tumorheterogenität zu überwinden.
Sowohl die US-amerikanischen NCCN-Leitlinien für Dickdarmkrebs als auch die chinesischen CSCO-Leitlinien für kolorektales Karzinom besagen, dass ctDNA-Tests zur Bestimmung des postoperativen Rezidivrisikos und zur Auswahl einer adjuvanten Chemotherapie bei Dickdarmkrebs prognostische und prädiktive Informationen liefern können, um die Entscheidung über die adjuvante Behandlung von Patienten mit Dickdarmkrebs im Stadium II oder III zu unterstützen. Die meisten bestehenden Studien konzentrieren sich jedoch auf ctDNA-Mutationen auf Basis der Hochdurchsatz-Sequenzierungstechnologie (NGS), die einen komplexen Prozess, lange Vorlaufzeiten und hohe Kosten mit sich bringt [3], mit etwas mangelnder Generalisierbarkeit und geringer Prävalenz unter Krebspatienten.
Bei Patienten mit Dickdarmkrebs im Stadium III kostet die NGS-basierte dynamische ctDNA-Überwachung bis zu 10.000 US-Dollar pro Besuch und erfordert eine Wartezeit von bis zu zwei Wochen. Mit dem Multigen-Methylierungstest ColonAiQ®, dem in dieser Studie untersuchten Test, können Patienten eine dynamische ctDNA-Überwachung zu einem Zehntel der Kosten durchführen lassen und erhalten innerhalb von nur zwei Tagen einen Bericht.
Angesichts der jährlich 560.000 Neuerkrankungen an Dickdarmkrebs in China besteht bei den klinischen Patienten, die hauptsächlich an Dickdarmkrebs im Stadium II–III erkrankt sind (der Anteil liegt bei etwa 70 %), ein dringenderer Bedarf an dynamischer Überwachung. Daher erreicht der Markt für die dynamische MRD-Überwachung von Dickdarmkrebs jedes Jahr Millionen von Menschen.
Die Forschungsergebnisse sind von großer wissenschaftlicher und praktischer Bedeutung. Groß angelegte prospektive klinische Studien haben bestätigt, dass die PCR-basierte Blut-ctDNA-Multigenmethylierungstechnologie zur Vorhersage und Überwachung des Wiederauftretens von Darmkrebs sowohl sensitiv, zeitnah als auch kosteneffizient eingesetzt werden kann. Dadurch wird eine präzise Medizin ermöglicht, die mehr Krebspatienten zugutekommt. Die Studie basiert auf ColonAiQ®, einem von KUNY entwickelten Multigenmethylierungstest für Darmkrebs, dessen klinischer Anwendungswert in der Früherkennung und Diagnose durch eine zentrale klinische Studie bestätigt wurde.
Gastroenterology (IF33.88), die führende internationale Fachzeitschrift auf dem Gebiet der Magen-Darm-Erkrankungen im Jahr 2021, berichtete über die Ergebnisse multizentrischer Forschungen des Zhongshan-Krankenhauses der Fudan-Universität, des Krebskrankenhauses der Fudan-Universität und anderer maßgeblicher medizinischer Einrichtungen in Zusammenarbeit mit KUNYAN Biological, die die hervorragende Leistung von ColonAiQ® ChangAiQ® bei der Früherkennung und Frühdiagnose von Dickdarmkrebs bestätigten und zunächst die potenzielle Anwendung bei der Prognoseüberwachung von Dickdarmkrebs untersuchten.
Um die klinische Anwendung der ctDNA-Methylierung bei der Risikostratifizierung, der Steuerung von Behandlungsentscheidungen und der Früherkennung von Rezidiven bei kolorektalem Krebs im Stadium I–III weiter zu validieren, schloss das Forschungsteam 299 Patienten mit kolorektalem Krebs im Stadium I–III ein, die sich einer radikalen Operation unterzogen hatten und bei jedem Nachuntersuchungszeitpunkt (im Abstand von drei Monaten) innerhalb einer Woche vor der Operation, eines Monats nach der Operation und in der postoperativen adjuvanten Therapie Blutproben für dynamische Blut-ctDNA-Tests sammelten.
Erstens wurde festgestellt, dass ctDNA-Tests das Rezidivrisiko bei Patienten mit Dickdarmkrebs frühzeitig vorhersagen können, sowohl präoperativ als auch früh postoperativ. Präoperative ctDNA-positive Patienten hatten eine höhere Wahrscheinlichkeit eines postoperativen Rezidivs als präoperative ctDNA-negative Patienten (22,0 % > 4,7 %). Frühe postoperative ctDNA-Tests sagten das Rezidivrisiko dennoch voraus: Einen Monat nach radikaler Resektion hatten ctDNA-positive Patienten ein 17,5-mal höheres Rezidivrisiko als negative Patienten; das Team fand auch heraus, dass kombinierte ctDNA- und CEA-Tests die Leistung bei der Rezidiverkennung leicht verbesserten (AUC = 0,849), der Unterschied im Vergleich zum ctDNA-Test allein (AUC = 0,839) jedoch nicht signifikant war. Der Unterschied im Vergleich zum ctDNA-Test allein (AUC = 0,839) war nicht signifikant.
Die klinische Stadienbestimmung in Kombination mit Risikofaktoren ist derzeit die wichtigste Grundlage für die Risikostratifizierung von Krebspatienten. Beim aktuellen Paradigma erleiden jedoch immer noch viele Patienten einen Rückfall [4]. Da in der Klinik sowohl Über- als auch Unterbehandlung vorkommen, besteht dringender Bedarf an besseren Stratifizierungsinstrumenten. Auf dieser Grundlage teilte das Team Patienten mit Dickdarmkrebs im Stadium III anhand der klinischen Bewertung des Rückfallrisikos (hohes Risiko (T4/N2) und niedriges Risiko (T1-3N1)) und der Dauer der adjuvanten Behandlung (3/6 Monate) in verschiedene Untergruppen ein. Die Analyse ergab, dass Patienten in der Hochrisiko-Untergruppe der ctDNA-positiven Patienten eine niedrigere Rückfallrate hatten, wenn sie sechs Monate lang eine adjuvante Therapie erhielten. In der Niedrigrisiko-Untergruppe der ctDNA-positiven Patienten gab es keinen signifikanten Unterschied zwischen dem adjuvanten Behandlungszyklus und den Patientenergebnissen. ctDNA-negative Patienten hatten eine signifikant bessere Prognose als ctDNA-positive Patienten und eine längere postoperative rezidivfreie Periode (RFS). Kolorektalkarzinom im Stadium I und im Stadium II mit geringem Risiko. Bei allen ctDNA-negativen Patienten trat innerhalb von zwei Jahren kein Rückfall auf. Daher wird erwartet, dass die Integration von ctDNA in klinische Merkmale die Risikostratifizierung weiter optimiert und das Auftreten von Rückfällen besser vorhersagt.
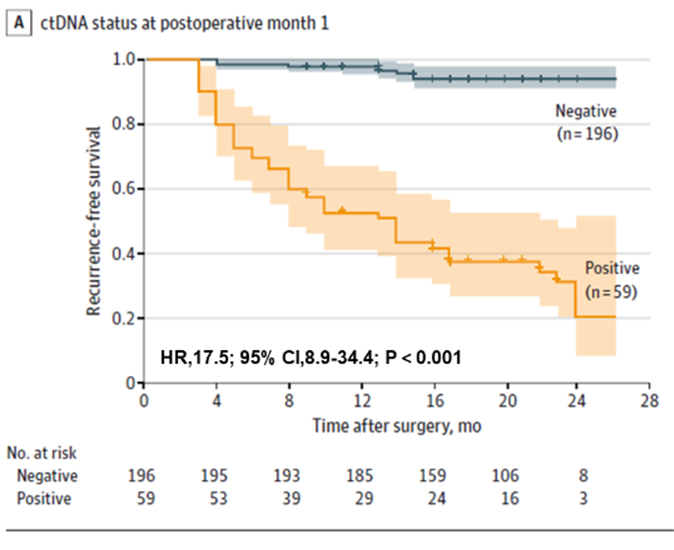
Abbildung 1. Plasma-ctDNA-Analyse an POM1 zur Früherkennung eines erneuten Auftretens von Darmkrebs
Weitere Ergebnisse des dynamischen ctDNA-Tests zeigten, dass das Rezidivrisiko bei Patienten mit positivem dynamischem ctDNA-Test während der Phase der Krankheitsrezidivüberwachung nach der definitiven Behandlung (nach radikaler Operation + adjuvanter Therapie) (Abbildung 3ACD) signifikant höher war als bei Patienten mit negativem ctDNA-Test, und dass ctDNA ein Tumorrezidiv bis zu 20 Monate früher anzeigen kann als die Bildgebung (Abbildung 3B), was die Möglichkeit einer Früherkennung eines Krankheitsrezidivs und einer rechtzeitigen Intervention bietet.
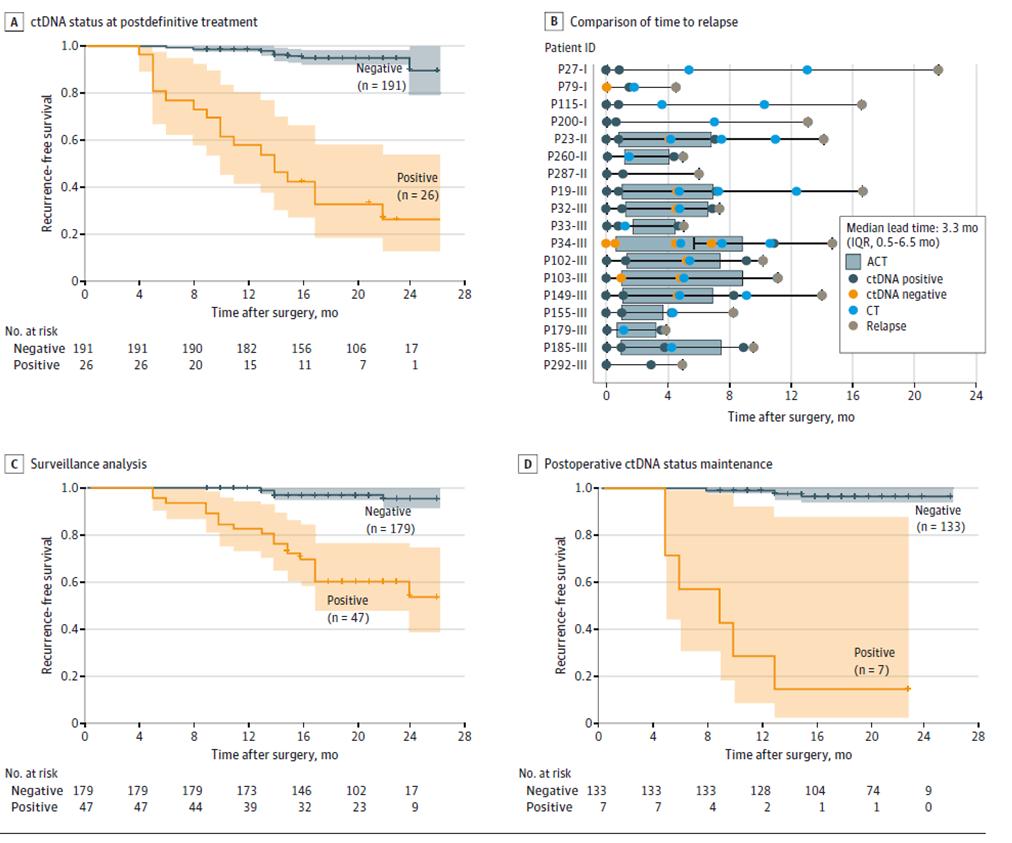
Abbildung 2. ctDNA-Analyse basierend auf einer Längsschnittkohorte zur Erkennung eines erneuten Auftretens von Darmkrebs
„Eine große Zahl translationaler medizinischer Studien zum Thema Dickdarmkrebs ist richtungsweisend für die Disziplin. Insbesondere ctDNA-basierte MRD-Tests bergen großes Potenzial zur Verbesserung der postoperativen Behandlung von Dickdarmkrebspatienten, indem sie eine Stratifizierung des Rezidivrisikos ermöglichen, Behandlungsentscheidungen leiten und ein frühzeitiges Rezidivmonitoring ermöglichen.
Der Vorteil der Wahl der DNA-Methylierung als neuer MRD-Marker gegenüber der Mutationserkennung besteht darin, dass kein Screening des gesamten Genoms von Tumorgeweben erforderlich ist, die Methode direkt für Bluttests verwendet werden kann und falsch-positive Ergebnisse aufgrund der Erkennung somatischer Mutationen vermieden werden, die aus normalem Gewebe, gutartigen Erkrankungen und klonaler Hämatopoese stammen.
Diese und andere damit zusammenhängende Studien bestätigen, dass der ctDNA-basierte MRD-Test der wichtigste unabhängige Risikofaktor für das Wiederauftreten von Dickdarmkrebs im Stadium I–III ist und als Entscheidungshilfe für die Behandlung dienen kann, darunter auch für die „Eskalation“ und „Herabstufung“ der adjuvanten Therapie. MRD ist der wichtigste unabhängige Risikofaktor für das Wiederauftreten nach einer Operation bei Dickdarmkrebs im Stadium I–III.
Der Bereich der MRD entwickelt sich rasant weiter und bietet eine Reihe innovativer, hochsensitiver und spezifischer Tests auf Basis der Epigenetik (DNA-Methylierung und Fragmentomik) und Genomik (ultratiefe gezielte Sequenzierung oder Gesamtgenomsequenzierung). Wir gehen davon aus, dass ColonAiQ® weiterhin große klinische Studien durchführen wird und sich zu einem neuen Indikator für MRD-Tests entwickeln kann, der Zugänglichkeit, hohe Leistung und Erschwinglichkeit vereint und in der klinischen Routinepraxis breit eingesetzt werden kann.“
Verweise
[1] Mo S, Ye L, Wang D, Han L, Zhou S, Wang H, Dai W, Wang Y, Luo W, Wang R, Xu Y, Cai S, Liu R, Wang Z, Cai G. Früherkennung molekularer Resterkrankungen und Risikostratifizierung für kolorektales Karzinom im Stadium I bis III durch zirkulierender Tumor-DNA-Methylierung. JAMA Oncol. 20. April 2023.
[2] „Die Belastung der chinesischen Bevölkerung durch Darmkrebs: Hat sie sich in den letzten Jahren verändert? , Chinese Journal of Epidemiology, Vol. 41, Nr. 10, Oktober 2020.
[3] Tarazona N, Gimeno-Valiente F, Gambardella V, et al. Gezielte Next-Generation-Sequenzierung zirkulierender Tumor-DNA zur Verfolgung minimaler Resterkrankungen bei lokalisiertem Dickdarmkrebs. Ann Oncol. 1. November 2019;30(11):1804-1812.
[4] Taieb J, André T, Auclin E. Verfeinerung der adjuvanten Therapie bei nicht-metastasiertem Dickdarmkrebs, neue Standards und Perspektiven. Cancer Treat Rev. 2019;75:1-11.
Veröffentlichungszeit: 28. April 2023
 中文网站
中文网站