Nat Med | Ein Multi-Omics-Ansatz zur Kartierung der integrierten Tumor-, Immun- und Mikrobenlandschaft von Darmkrebs enthüllt die Interaktion des Mikrobioms mit dem Immunsystem
Obwohl Biomarker für primären Dickdarmkrebs in den letzten Jahren umfassend untersucht wurden, stützen sich aktuelle klinische Leitlinien zur Festlegung von Behandlungsempfehlungen lediglich auf die Tumor-Lymphknoten-Metastasen-Stadienbestimmung und die Erkennung von DNA-Mismatch-Reparaturdefekten (MMR) oder Mikrosatelliteninstabilität (MSI) (zusätzlich zu standardmäßigen pathologischen Tests). Forscher haben einen fehlenden Zusammenhang zwischen auf der Genexpression basierenden Immunreaktionen, mikrobiellen Profilen und Tumorstroma in der Kolorektalkarzinom-Kohorte des Cancer Genome Atlas (TCGA) und dem Patientenüberleben festgestellt.
Im Laufe der Forschung wurde berichtet, dass quantitative Merkmale des primären kolorektalen Karzinoms, darunter die zelluläre, immunologische, stromale oder mikrobielle Natur des Krebses, signifikant mit den klinischen Ergebnissen korrelieren. Allerdings ist das Verständnis darüber, wie sich ihre Wechselwirkungen auf die Ergebnisse für die Patienten auswirken, noch immer unzureichend.
Um den Zusammenhang zwischen phänotypischer Komplexität und Krankheitsverlauf zu untersuchen, hat ein Forscherteam des Sidra Institute of Medical Research in Katar kürzlich einen integrierten Score (mICRoScore) entwickelt und validiert. Dieser Score identifiziert Patienten mit guten Überlebensraten durch die Kombination von Mikrobiommerkmalen und Immunabstoßungskonstanten (ICR). Das Team führte eine umfassende Genomanalyse von frisch gefrorenen Proben von 348 Patienten mit primärem Dickdarmkrebs durch. Diese umfasste die RNA-Sequenzierung von Tumoren und passendem gesundem Dickdarmgewebe, die Sequenzierung des gesamten Exoms, die Sequenzierung des tiefen T-Zell-Rezeptors und des bakteriellen 16S-rRNA-Gens, ergänzt durch eine Sequenzierung des gesamten Tumorgenoms zur weiteren Charakterisierung des Mikrobioms. Die Studie wurde in Nature Medicine unter dem Titel „Ein integrierter Tumor-, Immun- und Mikrobiom-Atlas des Dickdarmkrebses“ veröffentlicht.

Artikel in Nature Medicine veröffentlicht
AC-ICAM Übersicht
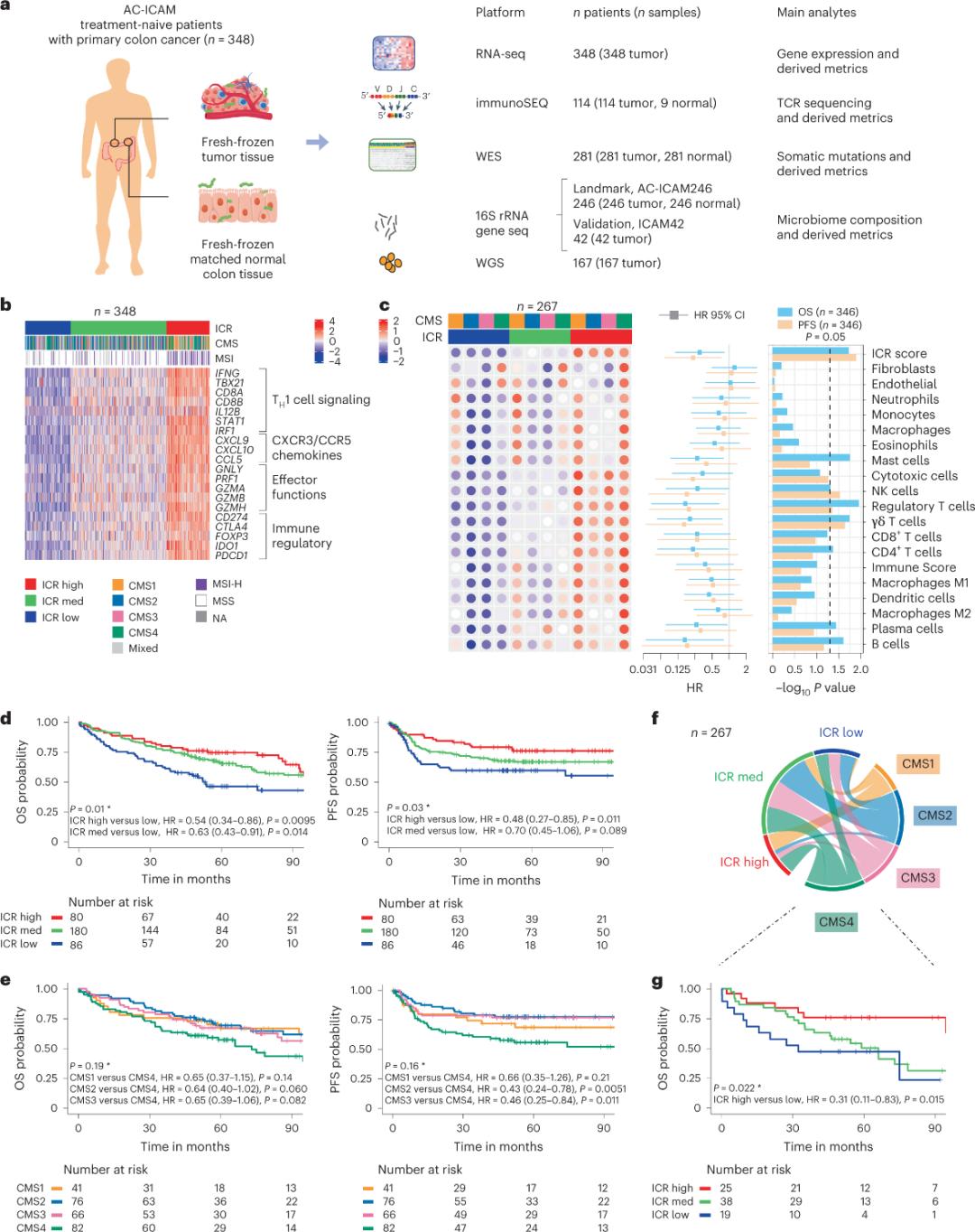
Die Forscher nutzten eine orthogonale Genomplattform zur Analyse frisch gefrorener Tumorproben und des dazugehörigen angrenzenden gesunden Dickdarmgewebes (Tumor-Normalgewebe-Paare) von Patienten mit histologischer Diagnose von Dickdarmkrebs ohne systemische Therapie. Basierend auf Exomsequenzierung (WES), RNA-Sequenzierungsdatenqualitätskontrolle und Screening der Einschlusskriterien wurden Genomdaten von 348 Patienten gespeichert und für die nachfolgende Analyse mit einer medianen Nachbeobachtungszeit von 4,6 Jahren verwendet. Das Forschungsteam nannte diese Ressource „Sidra-LUMC AC-ICAM: Eine Karte und ein Leitfaden zu den Interaktionen zwischen Immunsystem, Krebs und Mikrobiom“ (Abbildung 1).
Molekulare Klassifizierung mittels ICR
Das Forschungsteam erfasste einen modularen Satz immunogenetischer Marker für die kontinuierliche Krebsimmunüberwachung, die sogenannte Immunabstoßungskonstante (ICR), und optimierte die ICR, indem es sie zu einem 20-Gen-Panel verdichtete, das verschiedene Krebsarten abdeckt, darunter Melanom, Blasenkrebs und Brustkrebs. Die ICR wurde auch mit der Reaktion auf Immuntherapien bei verschiedenen Krebsarten, einschließlich Brustkrebs, in Verbindung gebracht.
Zunächst validierten die Forscher die ICR-Signatur der AC-ICAM-Kohorte. Dazu verwendeten sie einen auf dem ICR-Gen basierenden Koklassifizierungsansatz, um die Kohorte in drei Cluster/Immunsubtypen zu unterteilen: hohe ICR (heiße Tumoren), mittlere ICR und niedrige ICR (kalte Tumoren) (Abbildung 1b). Die Forscher charakterisierten die mit den Konsensus-Molekularsubtypen (CMS) verbundene Immunneigung, eine transkriptombasierte Klassifizierung von Dickdarmkrebs. Die CMS-Kategorien umfassten CMS1/Immun, CMS2/kanonisch, CMS3/metabolisch und CMS4/mesenchymal. Die Analyse zeigte, dass die ICR-Werte bei allen CMS-Subtypen negativ mit bestimmten Krebszellpfaden korrelierten und positive Korrelationen mit immunsuppressiven und stromabezogenen Pfaden nur bei CMS4-Tumoren beobachtet wurden.
Bei allen CMS war die Häufigkeit von natürlichen Killerzellen (NK-Zellen) und T-Zell-Subsets bei ICR-hohen Immunsubtypen am höchsten, mit größerer Variabilität bei anderen Leukozytensubsets (Abbildung 1c). ICR-Immunsubtypen wiesen unterschiedliche OS und PFS auf, mit einem progressiven Anstieg des ICR von niedrig nach hoch (Abbildung 1d), was die prognostische Rolle des ICR bei Darmkrebs bestätigt.
Abbildung 1. AC-ICAM-Studiendesign, immunbezogene Gensignatur, Immun- und molekulare Subtypen und Überleben.
ICR erfasst tumorangereicherte, klonal amplifizierte T-Zellen
Es wurde berichtet, dass nur eine Minderheit der in Tumorgewebe eindringenden T-Zellen spezifisch für Tumorantigene ist (weniger als 10 %). Daher wird die Mehrheit der intratumoralen T-Zellen als Bystander-T-Zellen (Bystander-T-Zellen) bezeichnet. Die stärkste Korrelation mit der Anzahl konventioneller T-Zellen mit produktiven TCRs wurde in Stromazell- und Leukozyten-Subpopulationen (erkannt durch RNA-Sequenzierung) beobachtet, die zur Schätzung von T-Zell-Subpopulationen verwendet werden können (Abbildung 2a). In den ICR-Clustern (Gesamt- und CMS-Klassifizierung) wurde die höchste Klonalität von Immun-SEQ-TCRs in den ICR-hohen und CMS-Subtyp-CMS1/Immungruppen beobachtet (Abbildung 2c), mit dem höchsten Anteil an ICR-hohen Tumoren. Unter Verwendung des gesamten Transkriptoms (18.270 Gene) gehörten sechs ICR-Gene (IFNG, STAT1, IRF1, CCL5, GZMA und CXCL10) zu den zehn Genen, die am stärksten positiv mit der TCR-Immun-SEQ-Klonalität assoziiert waren (Abbildung 2d). Die ImmunoSEQ-TCR-Klonalität korrelierte stärker mit den meisten ICR-Genen als die Korrelationen, die bei Verwendung tumorresponsiver CD8+-Marker beobachtet wurden (Abbildung 2f und 2g). Zusammenfassend lässt die obige Analyse darauf schließen, dass die ICR-Signatur das Vorhandensein tumorangereicherter, klonal amplifizierter T-Zellen erfasst und deren prognostische Auswirkungen erklären könnte.
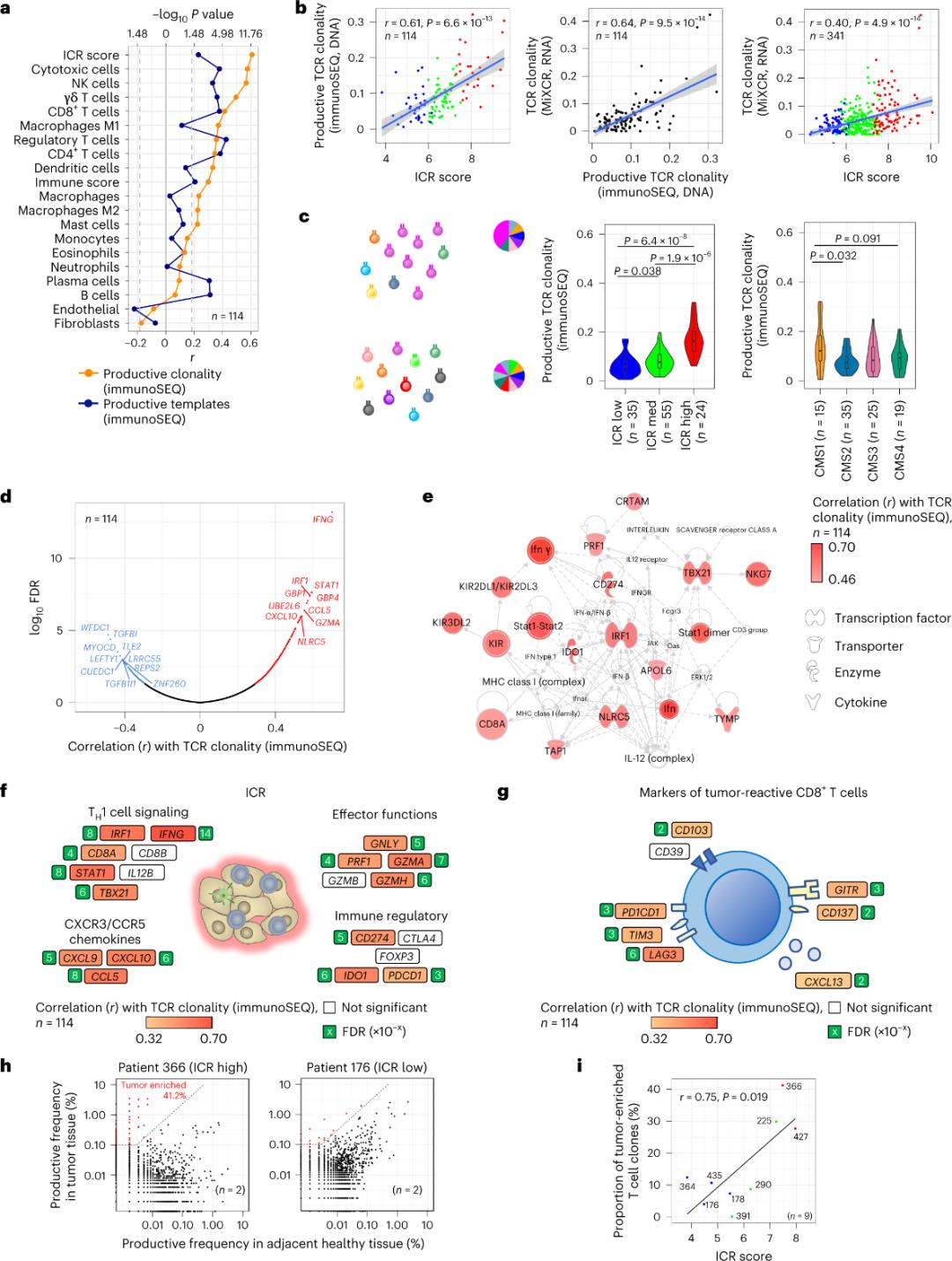
Abbildung 2. TCR-Metriken und Korrelation mit immunbezogenen Genen, Immun- und molekularen Subtypen.
Mikrobiomzusammensetzung in gesundem Gewebe und Dickdarmkrebsgewebe
Die Forscher führten eine 16S rRNA-Sequenzierung mit DNA durch, die aus passendem Tumor- und gesundem Dickdarmgewebe von 246 Patienten extrahiert wurde (Abbildung 3a). Zur Validierung analysierten die Forscher zusätzlich 16S rRNA-Gensequenzierungsdaten von weiteren 42 Tumorproben, für die keine passende normale DNA zur Analyse verfügbar war. Zunächst verglichen die Forscher die relative Häufigkeit der Flora zwischen passenden Tumoren und gesundem Dickdarmgewebe. Clostridium perfringens war in den Tumoren im Vergleich zu den gesunden Proben signifikant erhöht (Abbildung 3a-3d). Es gab keinen signifikanten Unterschied in der Alpha-Diversität (Diversität und Häufigkeit von Arten in einer einzigen Probe) zwischen Tumor- und gesunden Proben, und in Tumoren mit hohem ICR-Wert wurde eine leichte Verringerung der mikrobiellen Diversität im Vergleich zu Tumoren mit niedrigem ICR-Wert beobachtet.
Um klinisch relevante Zusammenhänge zwischen mikrobiellen Profilen und klinischen Ergebnissen zu erkennen, nutzten die Forscher 16S-rRNA-Gensequenzierungsdaten, um Merkmale des Mikrobioms zu identifizieren, die das Überleben vorhersagen. Im Rahmen von AC-ICAM246 führten die Forscher ein OS-Cox-Regressionsmodell aus, das 41 Merkmale mit von Null verschiedenen Koeffizienten (assoziiert mit einem unterschiedlichen Mortalitätsrisiko), sogenannte MBR-Klassifikatoren, auswählte (Abbildung 3f).
In dieser Trainingskohorte (ICAM246) war ein niedriger MBR-Wert (MBR < 0, niedriges MBR) mit einem signifikant geringeren Sterberisiko (85 %) verbunden. Forscher bestätigten den Zusammenhang zwischen niedrigem MBR (Risiko) und verlängertem OS in zwei unabhängig validierten Kohorten (ICAM42 und TCGA-COAD). (Abbildung 3) Die Studie zeigte eine starke Korrelation zwischen endogastrischen Kokken und MBR-Werten, die in Tumor- und gesundem Dickdarmgewebe ähnlich waren.
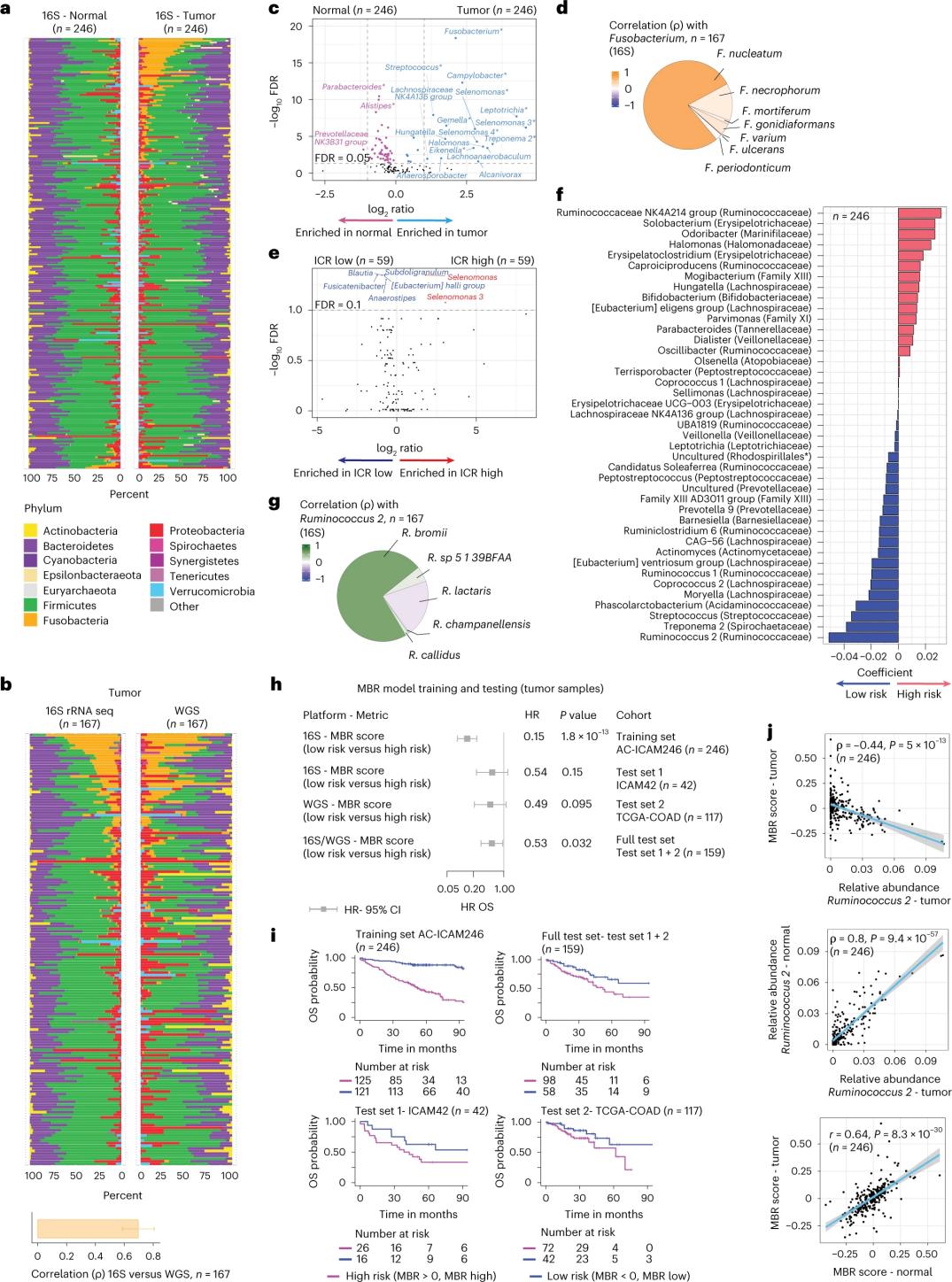
Abbildung 3. Mikrobiom in Tumor- und gesundem Gewebe und die Beziehung zu ICR und Patientenüberleben.
Abschluss
Der in dieser Studie verwendete Multi-Omics-Ansatz ermöglicht die gründliche Erkennung und Analyse der molekularen Signatur der Immunantwort bei Darmkrebs und deckt die Interaktion zwischen Mikrobiom und Immunsystem auf. Eine tiefe TCR-Sequenzierung von Tumor- und gesundem Gewebe ergab, dass der prognostische Effekt von ICR möglicherweise auf dessen Fähigkeit zurückzuführen ist, tumorangereicherte und möglicherweise tumorantigenspezifische T-Zell-Klone zu erfassen.
Durch Analyse der Zusammensetzung des Tumormikrobioms mittels 16S rRNA-Gensequenzierung in AC-ICAM-Proben identifizierte das Team eine Mikrobiomsignatur (MBR-Risiko-Score) mit hohem prognostischen Wert. Obwohl diese Signatur aus Tumorproben stammte, zeigte sich eine starke Korrelation zwischen gesundem Kolorektum und dem Tumor-MBR-Risiko-Score. Dies deutet darauf hin, dass diese Signatur die Zusammensetzung des Darmmikrobioms von Patienten erfassen könnte. Durch die Kombination der ICR- und MBR-Scores konnte ein multi-omischer Biomarker identifiziert und validiert werden, der das Überleben von Patienten mit Dickdarmkrebs vorhersagt. Der multi-omische Datensatz der Studie bietet eine Ressource, um die Biologie von Dickdarmkrebs besser zu verstehen und personalisierte Therapieansätze zu entwickeln.
Veröffentlichungszeit: 15. Juni 2023
 中文网站
中文网站